POBIERZ ARKUSZ: MATURA 2014 CHEMIA - POZIOM ROZSZERZONY
Matura 2014 Chemia poziom rozszerzony za Wami. Jak Wam poszło? Sprawdźcie arkusze CKE oraz odpowiedzi, które przygotowali dla Was nauczyciele poznańskich szkół.
POZIOM PODSTAWOWY TUTAJ: Matura 2014: Chemia [ODPOWIEDZI, ARKUSZ CKE] - podstawa
Matura 2014: Chemia - poziom rozszerzony - PRZYKŁADOWE ODPOWIEDZI:
ZADANIE 1
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian wybranych wielkości charakteryzujące pierwiastki chemiczne.
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami Ai B.
1. Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu
najwyższego stopnia utlenienia
promienia atomowego
promienia jonowego
2. Dla pierwiastków grup 1.-2. i 13.-17. okresu III strzałka B wskazuje kierunek wzrostu
najwyższego stopnia utlenienia
promienia atomowego
charakteru metalicznego
ZADANIE 2
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa.
1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje stopień utlenienia równy - I PRAWDA
2. Atomy pierwiastka II mają silniejszą tendencję do przyłączania elektronu niż atomy pierwiastka III. W konsekwencji pierwiastek II jest silniejszym utleniaczem niż pierwiastek III. PRAWDA
3. Wodorki pierwiastków II oraz III, rozpuszczając się w wodzie, ulegają dysocjacji jonowej. Stała dysocjacji wodorku pierwiastka II jest większa od stałej dysocjacji wodorku pierwiastka III. FAŁSZ
ZADANIE 3
Na poniższym wykresie przedstawiono zależność pewnej makroskopowej wielkości charakteryzującej pierwiastki chemiczne w funkcji ich liczny atomowej Z.
a) Opisz oś pionową wykresu, podając nazwę tej wielkości oraz jednostkę, w jakiej jest ona wyrażana.
Opis osi pionowej: liczba masowa
Pierwsza energia jonizacji E1 to najmniejsza energia potrzebna do oddzielenia pierwszego (o najwyższej energii) elektronu od atomu. Poniższy wykres przedstawia zależność pierwszej energii jonizacji atomów pierwiastków z czterech okresów układu okresowego od liczby atomowej Z tych pierwiastków.
b) Uzupełnij zdanie. Wybierz i podkreśl numery grupy pierwiastków podanych w nawiasie.
W danym okresie układu okresowego największą wartość pierwszej energii jonizacji E1 mają pierwiastki (pierwszej / trzeciej / siedemnastej / osiemnastej) grupy.
ZADANIE 4
W poniźszej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów galu występujących w przyrodzie.
Oblicz masę atomową galu. Wynik zaokrąglij do pierwszego miejsca po przecinku.
M = 68,9 x 60,1% + 70,9 x 39,95 = 41,4 + 28,3 = 69,7 [U]
ZADANIE 5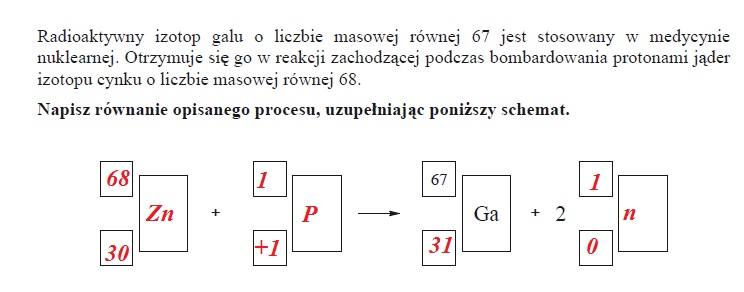
ZADANIE 6
W stanie podstawowym atom galu ma jeden niesparowany elektron.
Uzupełnij zdania. Wybierz i podkreśl symbol typu powłoki oraz wartość głównej i pobocznej liczby kwantowej spośród podanych w nawiasach.
Niesparowany elektron atomu galu w stanie podstawowym należy do podpowłoki typu (s/p/d/). Główna liczba kwantowa n opisująca stan tego elektronu wynosi (2/3/4) a poboczna liczba kwantowa l jest równa (0/1/2/3/).
ZADANIE 7
Gal jest metalem, który roztwarza się w mocnych kwasach oraz mocnych zasadach. W reakcjach tych tworzy sole, przechodząc na stopień utlenienia III. Drugi produkt tyvh reakcji jest taki sam ak w reakcjach glinu z mocnymi kwasami i zasadami. Poniżej przedstawiono schemat reakcji galu z mocnymi kwasami i zasadami.
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2.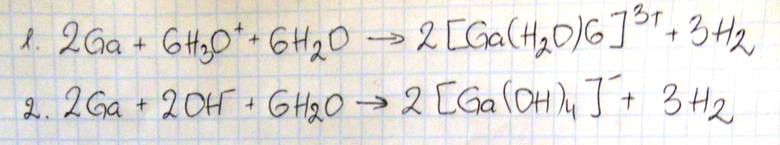
ZADANIE 8
Po wrzuceniu 0,720 g magnezu do 0,150 dm3 kwasu solnego o stężeniu 0,120 mol * dm3 zaszła reakcja opisana równaniem.
Opisz stężenie molowe kwasu solnego w momencie, gdy przereagowało 20% masy magnezu. W obliczeniach przyjmij, że objętość roztworu się nie zmieniła. Wynik podaj z dokładnością do dwóch miejsc po przecinku.

ZADANIE 9
Narysuj wzór elektronowy cząsteczki kwasu ortoborowego, oznaczając kreskmi wiązania oraz wolne pary elektronów. Wyjaśnij, dlaczego kwas borowy jest akceptorem jonów wodorotlenowych.
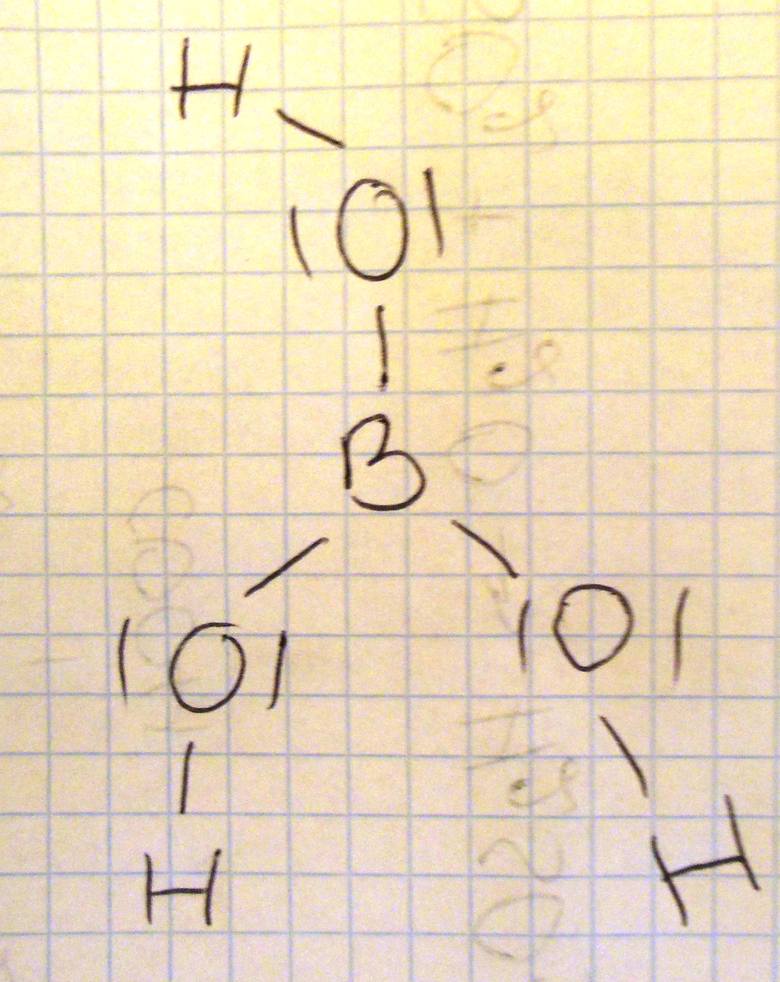
Wyjaśnienie: Atom boru by uzyskać oktet elektronowy jest zdolny do przyjęcia wolnej pary elektronowej
ZADANIE 10
Nazwij typ wiązania (ze względu na sposób jego powstawania), jakie tworzy się między atomem boru w cząsteczce kwasu ortoborowego i anionem wodorotlenkowym.
wiązanie kowalencyjne spolaryzowane
ZADANIE 11
Według teorii Arrheniusa kwasy to związku dysocjujące w roztworze wodnym na kationy wodoru i aniony reszty kwasowej. Bronsted zdefiniował kwasy jako donory protonów. Oznacza to, że kwasy to cząsteczki i jonu oddające proton. Zgodnie z teorią Lewisa kwasem nazywamy atom, cząsteczkę lub jon będący akceptorem jednej lub kilku par elektronów.
Wybierz teorię kwasów i zasad, zgodnie z którą H3BO3 - na podstawie reakcji z wodą opisanej powyżej - jest kwasem. Uzupełnij poniższe zdanie, podkreślając nazwisko autora tej teorii.
Na podstawie opisanej reakcji z wodą można stwierdzić, że H3BO3 jest kwasem według teorii kwasów i zasad (Arrheniusa / Bronsteda /Lewisa).
ZADANIE 12
Napisz, posługując sie wzorami półstrukturalnymi (grupowymi) związków organicznych, równanie reakcji kwasu ortoborowego z metanolem, w której stosunek molowy kwasu do alkoholu jest równy 1 : 3.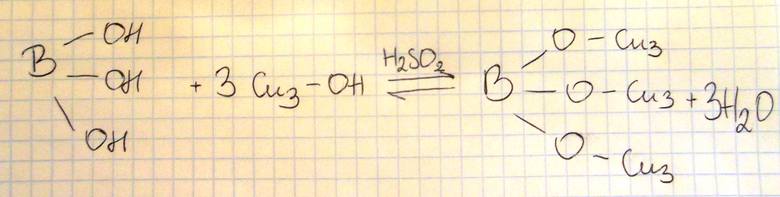
ZADANIE 13
ZADANIE 14
Podaj systematyczną nazwę kwasu izocytrynowego.
kwas 1-hydroksypropano - 1,2,3 - trikarboksylowy
ZADANIE 15
Napisz wzór półstrukturalny (grupowy) kwasu cytrynowego.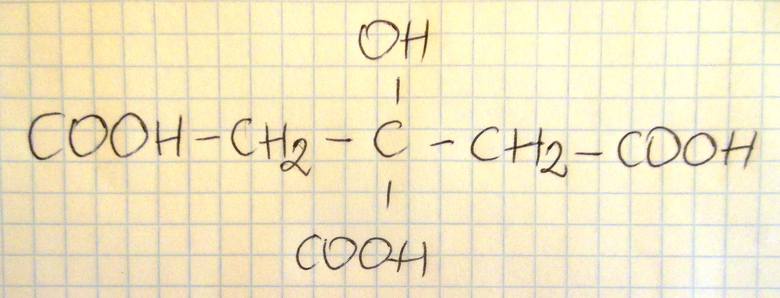
ZADANIE 16
Przeanalizuj budowę cząsteczek kwasu cytrynowego i izocytrynowego za względu na możliwość wystąpienia enanjometrii (izomerii optycznej). Wpisz w tabeli liczbę asymetrycznych atomów węgla w cząsteczkach tych kwasów oraz liczbę enancjomerów (izomerów optycznych) lub zaznacz ich brak.

ZADANIE 17
Do wodnego roztworu kwasu cytrynowego dodano nadmiar wodnego roztworu wodorowęglanu sodu NaHCO3. Stwierdzono, że temperatura mieszaniny poreakcyjnej jest znacznie niższa niż temperatura roztworów przed ich zmieszaniem. Zaobserwowano także wydzielanie bezbarwnego gazu.
a) Spośród podanych zależności wybierz i podkreśl tę, która jest prawdziwa dla entalpii procesu dokonującego się w opisanym doświadczeniu.
b) Napisz w formie cząsteczkowej równanie reakcji, która zaszła w czasie doświadczenia. Przyjmij, że kwas cytrynowy przereagował z wodorowęglanem sodu w stosunku molowym 1 : 3. Zastosuj następujący wzór kwasu cytrynowego: C3H4(OH)(COOH)3.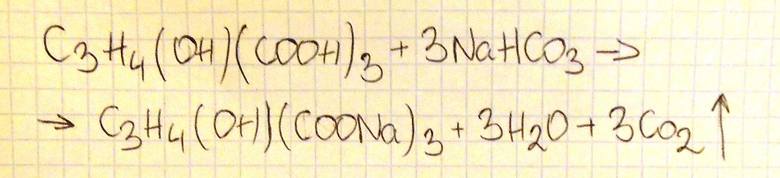
ZADANIE 18
W temperaturze 20 °C rozpuszczalność uwodnionego węglanu sodu o wzorze Na2CO3.10H2O wynosi 21,5 grama w 100 gramach wody. Oblicz, jaki procent masy roztworu nasyconego w temperaturze 20 °C stanowi masa soli bezwodnej Na2CO3. Wynik podaj z dokładnością do pierwszego miejsca po przecinku.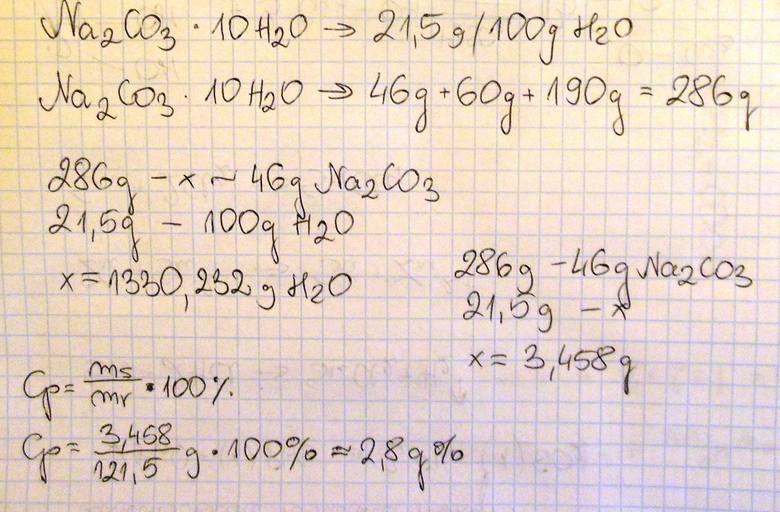
ZADANIE 19
Wytrącanie trudno rozpuszczalnych siarczków metali jest ważną metodą analityczną. W tych reakcjach jako odczynnik stosowany jest siarkowodór, który uzyskuje się w wyniku hydrolizy amidu kwasu tiooctowego (tioacetamidu).
Napisz w formie cząsteczkowej równanie reakcji hydrolizy tioacetamidu, posługując się wzorami półstrukturalnymi (grupowymi) reagentów organicznych.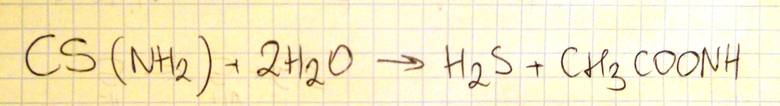
ZADANIE 20
Napisz równania reakcji etapów dysocjacji kwasu siarkowodorowego, którym odpowiadają wartości stałej dysocjacji podane w tabeli.
ZADANIE 21
Czy w roztworze I wytrąci się osad ZnS, a w roztworze II osad CuS? Wpisz TAK albo NIE w odpowiednie rubryki tabeli.
W roztworze I wytrąci się osad ZnS. NIE
W roztworze II wytrąci się osad CuS. TAK
ZADANIE 22
Korzystając z informacji na temat dysocjacji nadtlenku wodoru w wodzie, wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
Nadtlenek wodoru jest kwasem Bronsteda, a sprzężoną z nim zasadą jest jon OH-. FAŁSZ
Woda jest akceptorem protonów pochodzących od sprzężonego z nią kwasu Bronsteda, którym jest nadtlenek wodoru.PRAWDA
Cząsteczka H2O2 i jon 2 HO- stanowią sprzężoną parę kwas - zasada w ujęciu teorii Bronsteda. PRAWDA
ZADANIE 23
Korzystając z informacji na temat struktury cząsteczki nadtlenku wodoru, uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie.
1. W cząsteczce nadtlenku wodoru atomy wodoru połączone są z atomami tlenu wiązaniami kowalencyjnymi (spolaryzowanymi / niespolaryzowanymi), a między atomami tlenu występuje wiązanie kowalencyjne (spolaryzowane / niespolaryzowane).
2. Cząsteczka nadtlenku wodoru jest (polarna / niepolarna).
3. Kształt cząsteczki nadtlenku wodoru można wyjaśnić, jeżeli się założy hybrydyzację typu (sp3 / sp2 / sp) walencyjnych orbitali atomowych tlenu.
ZADANIE 24
Opisz obserwowane zmiany barw, które świadczą o przebiegu reakcji w probówkach I i II (uwzględnij barwę zawartości obu probówek przed reakcją i po jej zajęciu).
Probówka I - z fioletowej na bezbarwną
Probówka II - z bezbarwnego na fioletowy
ZADANIE 25
ZADANIE 26
Napisz w formie jonowej skróconej równania reakcji chemicznych, które przebiegły w probówkach I i II.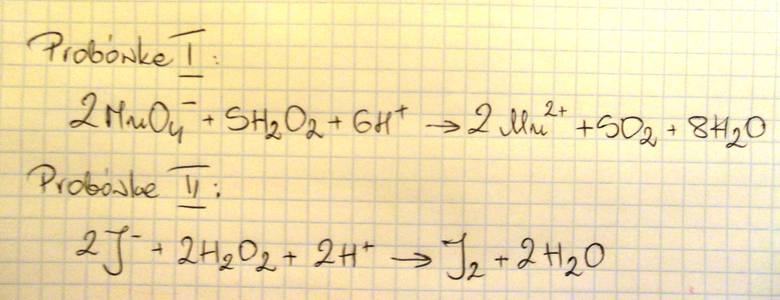
ZADANIE 27
ZADANIE 28
ZADANIE 29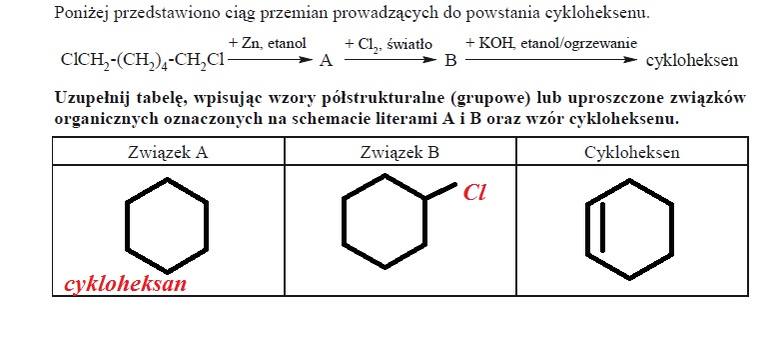
ZADANIE 30
Na podstawie powyższej informacji oceń, czy skraplanie benzenu w temperaturze 352,2 K jest przemianą egzo- czy endotermiczną.
Skraplanie benzenu w temperaturze 352,2 K jest przemianą endotermiczną.
ZADANIE 31
ZADANIE 32
ZADANIE 33
ZADANIE 34
ZADANIE 35
ZADANIE 36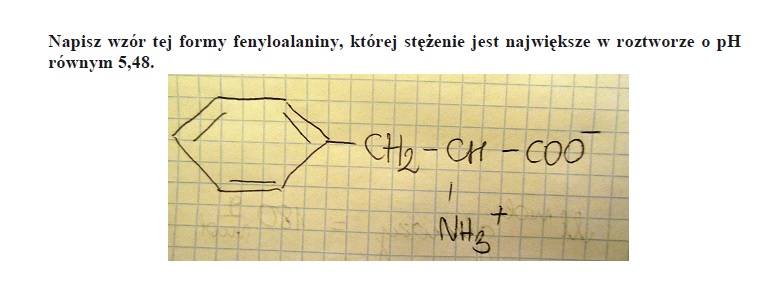
ZADANIE 37
ZADANIE 38
Wskaż przyczynę różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny.
Różnica - różna ilości grup funkcyjnych w budowie obu cząsteczek.
ZADANIE 39
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe
1. W reakcji z maltozy wodorotlenek miedzi(II) uległ redukcji do Cu2O, o czym świadczy powstanie ceglastego osadu. PRAWDA
2. Czarny osad powstający w probówce z roztworem sacharozy to CuO, który jest produktem rozkładu wodorotlenku miedzi(II). PRAWDA
3. Sacharoza nie wykazała właściwości redukujących, ponieważ w jej cząsteczkach wiązanie glikozydowe łączy pierwszy atom węgla reszty glukozy z drugim atomem węgla reszty fruktozy. PRAWDA
Dołącz do nas na Facebooku!
Publikujemy najciekawsze artykuły, wydarzenia i konkursy. Jesteśmy tam gdzie nasi czytelnicy!
Dołącz do nas na X!
Codziennie informujemy o ciekawostkach i aktualnych wydarzeniach.
Kontakt z redakcją
Byłeś świadkiem ważnego zdarzenia? Widziałeś coś interesującego? Zrobiłeś ciekawe zdjęcie lub wideo?
![Matura 2014: Chemia - poziom rozszerzony [ODPOWIEDZI, ARKUSZE CKE]](https://d-art.ppstatic.pl/kadry/k/r/1/7e/21/53750e77ae91d_o_medium.jpg)




