Próbna matura 2017. Chemia - sprawdź się!
Zadania w arkuszu z chemii będą miały formę zamkniętą lub otwartą. W zadaniach zamkniętych, na przykład wielokrotnego wyboru, prawda-fałsz, na dobieranie, zdający wybiera jedną z podanych opcji odpowiedzi.
Natomiast w zadaniach otwartych – zdający samodzielnie formułuje odpowiedź związaną na przykład z podaniem wzorów chemicznych, równań reakcji chemicznych, obliczeń, wypowiedzi słownych.
W arkuszu będą przeważały zadania otwarte:
- będą występowały pojedynczo lub w wiązkach tematycznych,
- będą odnosiły się do różnorodnych materiałów źródłowych zamieszczonych w arkuszu, np. przedstawionych wykresów, rysunków, tabel, schematów
PRÓBNA MATURA 2017 Z CHEMII
Informacja do zadań 1–3
Podstawowym źródłem surowcowym wodoru na Ziemi jest woda. Wodór występuje także w złożach węgli kopalnych, ropy naftowej i gazu ziemnego, a także w materii organicznej (biomasa). Zastosowanie wodoru budzi ogromne nadzieje, a istniejące już rozwiązania, umożliwiające pozyskiwanie z niego energii, pozwalają przewidywać jego wykorzystanie do ogrzewania budynków, w transporcie i w przemyśle. Największe znaczenie, szczególnie dla krajów nieposiadających znaczących zasobów mineralnych, ma możliwość pozyskiwania wodoru z biomasy – nieograniczonego źródła surowcowego. Niestety, technologie związane z energetycznym zastosowaniem wodoru są w chwili obecnej bardzo drogie, może im podołać jedynie przemysł związany z lotami kosmicznymi.
Poniżej przedstawiono równania wybranych reakcji wykorzystywanych w technologiach pozyskiwania energii z wykorzystaniem wodoru. (Wartości entalpii podano dla reakcji, które przebiegają pod stałym ciśnieniem, a temperatura produktów została doprowadzona do temperatury początkowej substratów).
Zadanie 1.
Uzupełnij poniższe zdanie, podkreślając odpowiednie określenie w każdym nawiasie.
Reakcja oznaczona literą A. ( wymaga / nie wymaga ) dostarczenia energii, ponieważ proces ten jest ( egzotermiczny / endotermiczny ).
Zadanie 2.
Na podstawie tekstu wprowadzającego oceń prawdziwość podanych zdań. Wpisz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
1. Wodór nazywany jest paliwem przyszłości, ponieważ obecnie nie jest wykorzystywany do pozyskiwania energii. P/F
2. Podczas spalania wodoru nie powstają substancje powodujące zanieczyszczenie środowiska naturalnego. P/F
3. Technologie pozyskiwania wodoru z biomasy i surowców mineralnych są tanie. P/F
Zadanie 3.
Tlenek węgla(II) otrzymany w reakcji A. jest jednym z substratów reakcji B.
Oblicz, ile m3 wodoru, w przeliczeniu na warunki normalne, można otrzymać łącznie w reakcjach A. i B., jeśli początkowa objętość metanu w tych warunkach była równa 2 m3 . Reakcja A. przebiegała z wydajnością 80%, a reakcja B. z wydajnością 60%. Wynik podaj z dokładnością do liczby całkowitej.
Zadanie 4.
Zweryfikuj tę hipotezę, wykonując odpowiednie obliczenia. Uzasadnij swoją opinię przez podkreślenie właściwego zwrotu w każdym nawiasie i dokończenie zdania.
Obliczenia: ....
Hipoteza ( była / nie była ) poprawna. Odczyn roztworu ( jest / nie jest ) obojętny, ponieważ ....
Zadanie 5.
Przeprowadzono dwa doświadczenia w temperaturze T. Podczas pierwszego doświadczenia do kwasu solnego dodawano kroplami wodny roztwór wodorotlenku sodu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. Podczas drugiego doświadczenia do wodnego roztworu kwasu etanowego (octowego) dodawano kroplami wodny roztwór wodorotlenku sodu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. Przebieg doświadczeń zilustrowano poniższym schematem.
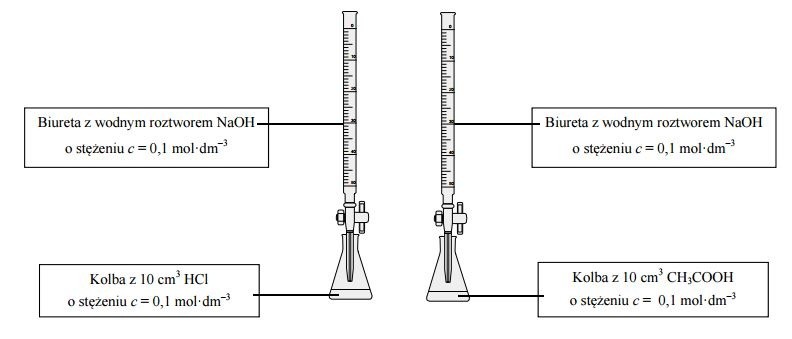
Otrzymane podczas wykonywanych doświadczeń wyniki umieszczono na poniższych wykresach A. i B., ilustrujących zależność pH od objętości dodanego roztworu wodorotlenku sodu.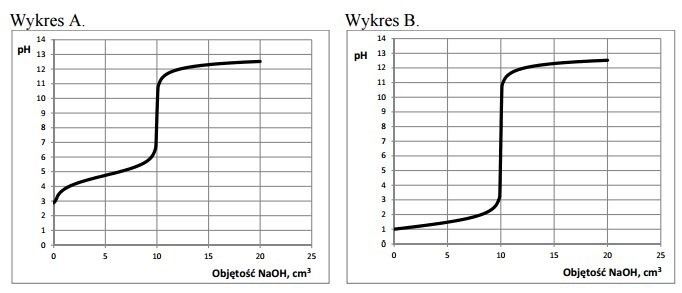
a) Odczytaj z wykresów A. i B. początkowe (przed dodaniem wodnego roztworu NaOH) wartości pH roztworów kwasów. Na tej podstawie wskaż wykres (A. lub B.), który przedstawia wyniki doświadczenia z użyciem kwasu solnego. Uzasadnij swój wybór.
Odczyt pH z wykresu A.: ....
Odczyt pH z wykresu B.: ....
Wykres, przedstawiający wyniki doświadczenia z użyciem kwasu solnego, oznaczony jest
literą .......
Uzasadnienie wyboru: ......
Odczytana z wykresu A. wartość pH roztworu otrzymanego po zmieszaniu stechiometrycznych ilości reagentów wynosi około 9, natomiast wartość pH roztworu, otrzymanego po zmieszaniu stechiometrycznych ilości reagentów, odczytana z wykresu B. jest równa 7.
b) Wyjaśnij, dlaczego roztwory otrzymane po zmieszaniu stechiometrycznych ilości reagentów w obu doświadczeniach mają różne pH. Zapisz w formie jonowej skróconej równania reakcji, które potwierdzą Twoje wyjaśnienia dotyczące odczynu roztworów otrzymanych w obu doświadczeniach.
Wyjaśnienie: .......
Równania reakcji: .......
Informacja do zadań 6–7
Pewien węglowodór zawiera 92,3% węgla w procentach masowych.
Na lekcji chemii uczniowie zastanawiali się, jaki związek spełnia podane powyżej założenie.
Na podstawie informacji o zawartości procentowej węgla jeden z uczniów ustalił, wykonując poprawne obliczenia, że stosunek liczby atomów węgla do liczby atomów wodoru w cząsteczce tego związku wynosi 1 : 1. Na tej podstawie stwierdził, że związkiem tym jest acetylen (etyn) o wzorze C2H2, ponieważ jest on węglowodorem i węgiel stanowi 92,3% masy jego cząsteczki. Jako dodatkowy argument przytoczył opinię, że danemu składowi (wyrażonemu w procentach masowych) odpowiada jeden, określony związek chemiczny.
Zadanie 6.
Wypełnij poniższą tabelę, a następnie oceń poprawność przytoczonej przez ucznia opinii i uzasadnij swoje stanowisko. 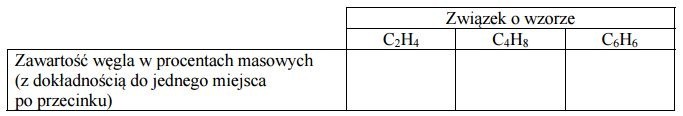
Ocena poprawności opinii wraz z uzasadnieniem: .......
Zadanie 7.
Oceń, czy do jednoznacznego ustalenia wzoru strukturalnego związku organicznego wystarczająca jest informacja o jego składzie wyrażonym w procentach masowych i masie molowej. Uzasadnij swoje stanowisko.
Odpowiedź wraz z uzasadnieniem: ..........
Informacja do zadania 8-10. 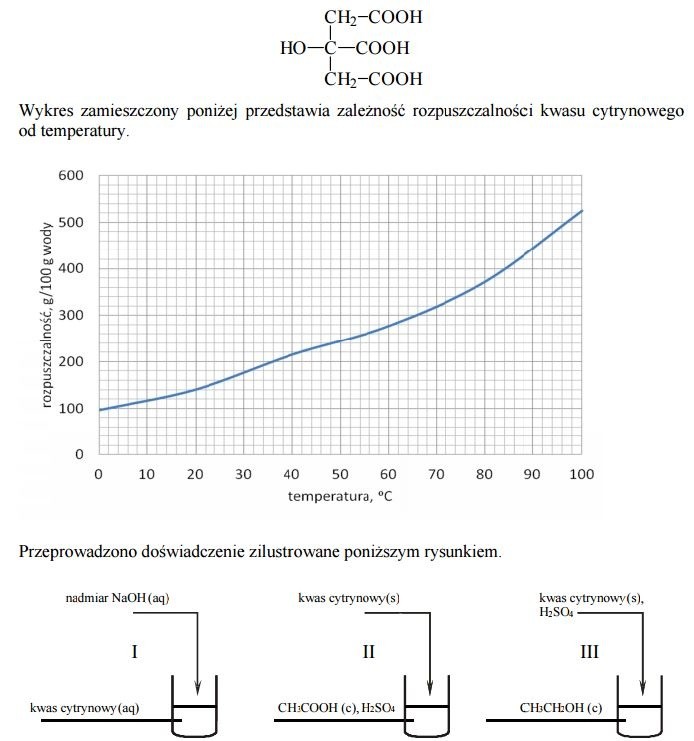
Naczynie II dodatkowo ogrzano. W naczyniu III otrzymano kilka produktów, wśród nich związki, których cząsteczki są chiralne.
Zadanie 8.
Oceń, czy można przygotować wodny roztwór kwasu cytrynowego o stężeniu 75% masowych o temperaturze 20 stopni C. Wykonaj odpowiednie obliczenia oraz uzasadnij swoją ocenę.
Obliczenia: .....
Ocena i jej uzasadnienie: .....
Zadanie 9.
Zapisz w formie cząsteczkowej równania reakcji zachodzących w naczyniach I oraz II.
Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
a) Równanie reakcji zachodzącej w naczyniu I: ....
b) Równanie reakcji zachodzącej w naczyniu II: ....
Zadanie 10.
a) Czy cząsteczka kwasu cytrynowego jest chiralna, czy achiralna? Wybierz i podkreśl odpowiedź A. albo B. oraz jej uzasadnienie 1. albo 2. albo 3.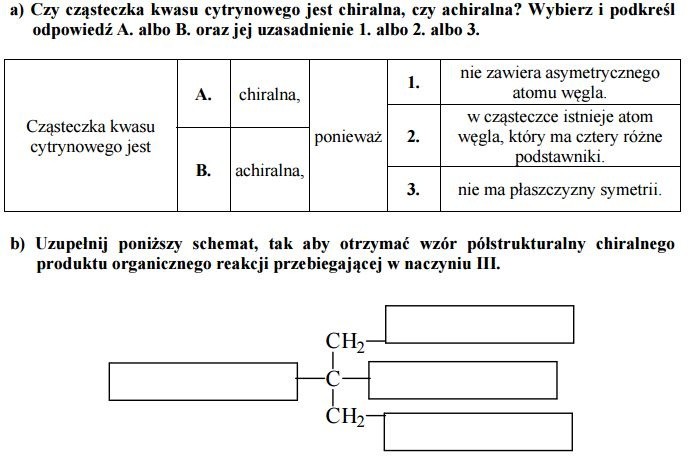
Zadanie 11.
Punkt izoelektryczny aminokwasu (pI) to wartość pH roztworu, w której dominuje aminokwas w formie jonu obojnaczego. W roztworze o pH innym niż pI dominuje forma kationowa lub anionowa aminokwasu.
Jeśli roztwór aminokwasu o pH innym niż jego pI umieści się w porowatym ośrodku i podda działaniu pola elektrycznego, to odpowiedni jon będzie przemieszczał się w kierunku jednej z elektrod. Szybkość poruszania się jonu jest odwrotnie proporcjonalna do masy molowej aminokwasu.
a) Na podstawie wartości punktów izoelektrycznych (pI) izoleucyny i glicyny napisz wzór tej formy jonowej, która będzie dominować w roztworze tego aminokwasu o pH = 7. Skorzystaj z Karty wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki.
Wzór formy jonowej izoleucyny ........
Wzór formy jonowej glicyny ..........
Przygotowano roztwór mieszaniny izoleucyny i glicyny o takim pH, w którym oba aminokwasy występują w formie kationów. Następnie otrzymany roztwór naniesiono na bibułę nasączoną roztworem elektrolitu. Przygotowaną bibułę umieszczono w polu
elektrycznym, przykładając do jej końców elektrody podłączone do źródła prądu stałego.
b) Dokończ poniższe zdanie, podkreślając odpowiedź A. albo B. i jej uzasadnienie C. albo D.
Kation aminokwasu ( A. / B. ) będzie poruszał się szybciej do elektrody w zewnętrznym polu elektrycznym, gdyż ma on masę molową ( C. / D. ) niż kation drugiego aminokwasu.
A. izoleucyny
B. glicyny
C. większą
D. mniejszą
Zadania pochodzą z informatorów CKE
SPRAWDŹ SWOJE ODPOWIEDZIPróbna matura 2017. Chemia - sprawdź się! Jak Wam poszło? Komentujcie!
Dołącz do nas na Facebooku!
Publikujemy najciekawsze artykuły, wydarzenia i konkursy. Jesteśmy tam gdzie nasi czytelnicy!
Dołącz do nas na X!
Codziennie informujemy o ciekawostkach i aktualnych wydarzeniach.
Kontakt z redakcją
Byłeś świadkiem ważnego zdarzenia? Widziałeś coś interesującego? Zrobiłeś ciekawe zdjęcie lub wideo?
